2019CSCO速递丨程颖教授:BGB-A317-312——含铂方案±替雷利珠单抗用于未经治疗广泛期SCLC的Ⅲ期临床试验
来源:吉林省肿瘤医院 时间:2019-09-25 浏览: 次

程颖
二级教授,博士研究生导师
享受国务院特殊津贴
卫生部突出贡献中青年专家
吉林省肿瘤医院院长,吉林省肿瘤防治研究所所长,吉林省肿瘤防治办公室主任,吉林省癌症中心主任,吉林省肺癌诊疗中心主任。CSCO副理事长,CSCO小细胞肺癌专业委员会主任委员,CSCO非小细胞肺癌专业委员会副主任委员,CSCO肝癌专家委员会副主任委员,CSCO肿瘤大数据专家委员会副主任委员。中国抗癌协会肺癌专业委员会副主任委员,中国抗癌协会临床化疗专业委员会副主任委员,中华医学会肿瘤学分会委员,全国医师定期考核肿瘤专业编辑委员会副主任委员,国家卫生计生委常见肿瘤规范化诊疗专家组成员,中国医师协会肺癌培训专业委员会副主任委员。吉林省医师协会肿瘤医师分会主任委员,吉林省医学会肿瘤专业委员会主任委员,担任《中华肿瘤杂志》等多家杂志编委。
研究背景
2018年,据估计,肺癌是中国男性和女性癌症死亡的主要原因1,其中,小细胞肺癌(SCLC)约占所有肺癌的15%2。在过去,中国未经治疗的广泛期SCLC患者的一线标准治疗为化疗(依托泊苷+顺铂或卡铂)3。尽管接受联合化疗的广泛期SCLC患者的初始缓解率为60%~70%,但这些患者的预后仍较差,中位总生存期(OS)约为9~11个月,2年生存率低于5%,这提示存在高度未满足的医疗需求4。
替雷利珠单抗是一种创新型单克隆抗体,对PD-1具有高亲和力和特异性。经过特殊地结构优化,替雷利珠单抗减少了与巨噬细胞上的FcγR结合,以消除抗体依赖性吞噬作用(T细胞清除机制)和抗PD-1治疗的潜在耐药性(图1)5,6。早期临床研究(NCT02407990;NCT03432598)结果显示,替雷利珠单抗无论是单药治疗还是联合化疗在晚期肺癌(包括SCLC)患者中均表现出良好的的抗肿瘤活性及耐受性7,8。
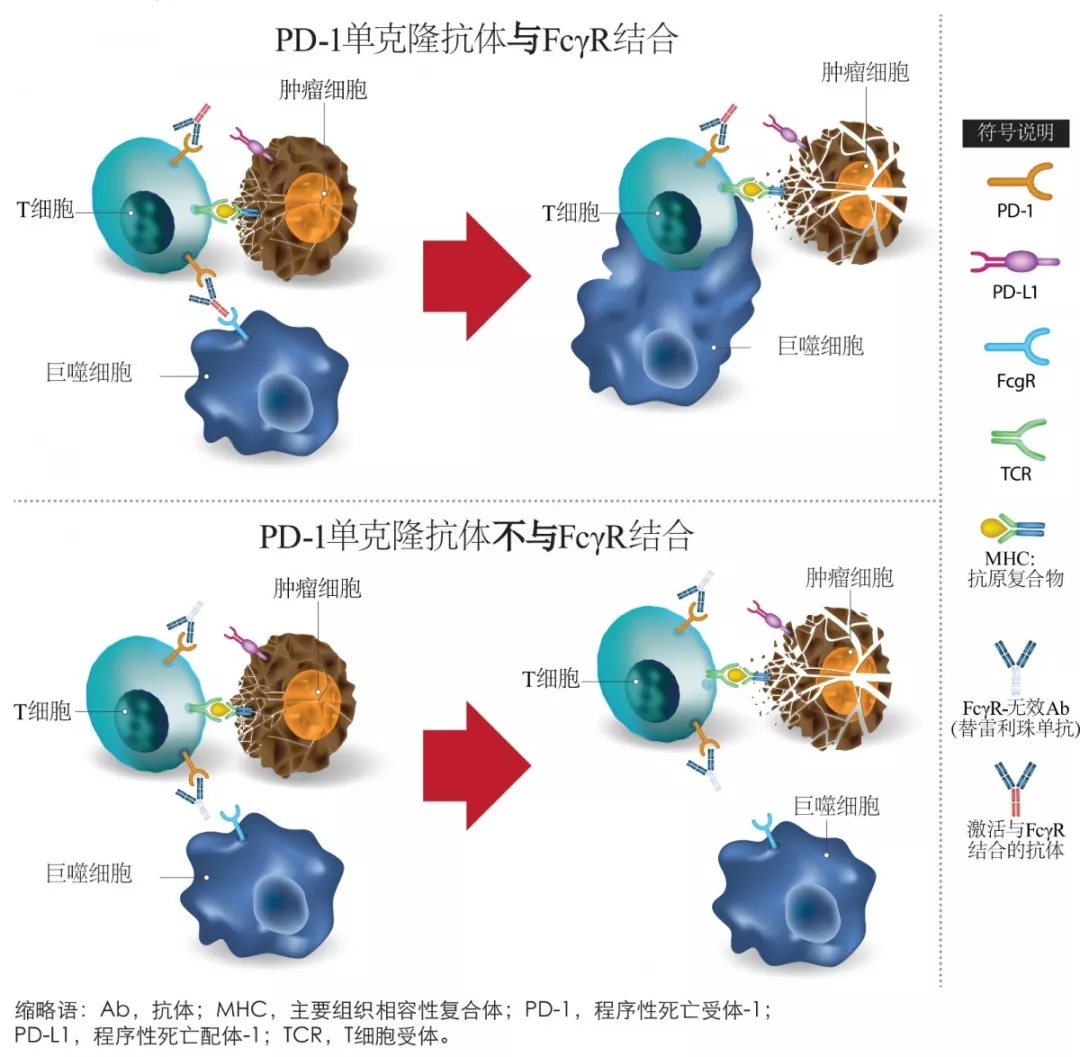
图1:不与FcγR结合可能有助于防止巨噬细胞介导的T细胞清除
研究方法
总体设计和研究目的
本项随机、双盲、安慰剂对照、Ⅲ期研究(NCT04005716)正在中国50家研究中心进行,旨在比较替雷利珠单抗+铂类和依托泊苷与安慰剂+铂类和依托泊苷作为一线疗法治疗初治的广泛期SCLC患者(N=364)(图2)。
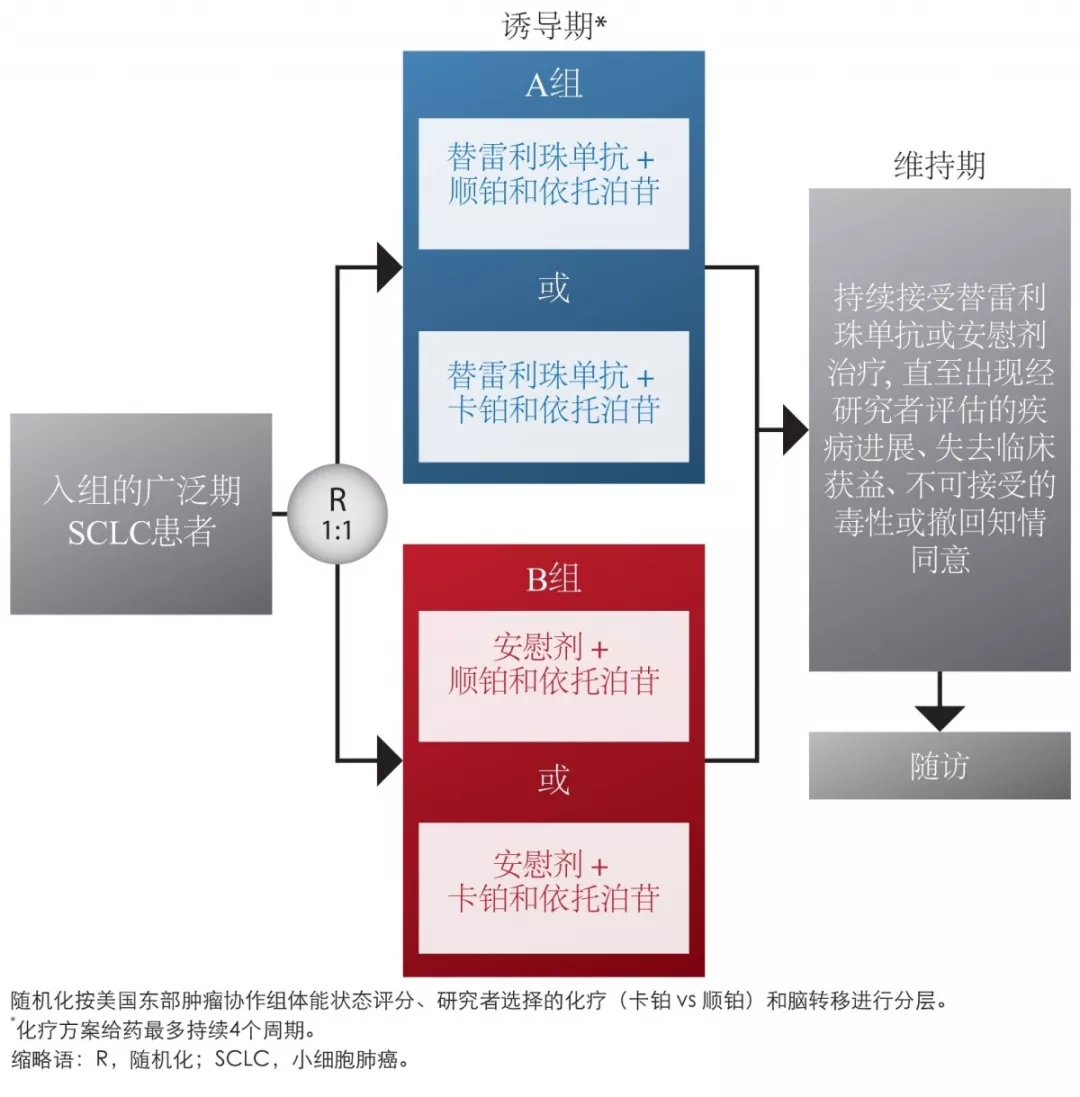
图2:研究设计
主要目的是比较替雷利珠单抗+化疗治疗组与安慰剂+化疗治疗组患者中经研究者评估的生存期[无进展生存期(PFS)和总生存期(OS)],次要目的是评价研究者根据RECIST第1.1版标准评估的总缓解率(ORR)、疾病控制率(DCR)和缓解持续时间(DoR),生活质量结局指标,以及联合治疗的安全性/耐受性特征。
研究人群
✦研究人群包括符合以下条件的患者:成人患者(≥18岁),经组织学或细胞学确诊为广泛期SCLC,美国东部肿瘤协作组体能状态(ECOGPS)评分≤1,血液学、肾脏和肝功能正常。
◇患者既往未接受过针对广泛期SCLC的治疗。
✦接受过根治性治疗的局限期SCLC患者在完成化疗、放疗或放化疗后与诊断为广泛期SCLC之间的无治疗间期必须≥6个月。
✦如果患者患有活动性软脑膜疾病或不受控制、未经治疗的脑转移,或存在间质性肺病、非感染性肺炎或不受控制的全身性疾病病史,或随机分组前≤2年内患有任何其他活动性恶性肿瘤,或既往接受过特异性靶向T细胞共刺激或免疫检查点通路的药物治疗,也不可进入本研究。
治疗
患者将以1:1的比例随机接受替雷利珠单抗200mgIV每3周一次(Q3W;每个周期(21天)的第1天)联合研究者选择的化疗(A组)或安慰剂IVQ3W联合研究者选择的化疗(B组)。
✦研究者可以选择两种化疗方案:
◇顺铂75mg/m2IVQ3W(每个周期的第1天)联合依托泊苷100mg/m2IVQ3W(每个周期的第1-3天);
◇或卡铂AUC5IVQ3W(每个周期的第1天)联合依托泊苷100mg/m2IVQ3W(每个周期的第1~3天)。
✦随机化将按ECOGPS评分、研究者选择的化疗和脑转移进行分层。
✦化疗方案给药至多持续4个周期。
✦A组与B组之间不允许患者交叉。
✦将持续给予替雷利珠单抗或安慰剂维持治疗,直至出现研究者评估的疾病进展、失去临床获益、不可接受的毒性、撤回知情同意或满足其他停药标准。
研究评估和统计分析
将在基线时进行肿瘤评估,每6周(±7天)一次,共48周,此后每9周(±7天)一次,直至出现影像学疾病进展。
✦将使用包括所有随机分组患者的意向性治疗(ITT)分析集评估主要终点PFS和OS;将通过对数秩检验、Kaplan‑Meier方法和Cox回归模型估计治疗效果。
◇PFS定义为从随机化至首次由研究者评估确定为疾病进展或因任何原因死亡的时间,以先发生者为准。
◇OS定义为从随机化至因任何原因死亡的时间。
✦在研究过程中,将通过监测AE/SAE(根据美国国家癌症研究所不良事件通用术语标准[NCI-CTCAE]v5.0划分的毒性分级)及生命体征、体格检查、心电图、ECOGPS评分、实验室检查等对药物安全性/耐受性进行评估。要求对所有AE进行记录,直到末次给药后30天(包括化疗药物)。
◇免疫相关不良事件(irAE)的记录将一直持续到替雷利珠单抗或安慰剂末次给药后90天。
◇将在安全性分析集中进行安全性和耐受性评估,安全性分析集包括接受≥1剂任何分配治疗的所有受试者。
✦将在ITT分析集中进行生活质量评估,使用汇总统计量进行报告。
点评
作为近几年肿瘤领域的最重要的突破,免疫检查点抑制剂已经彻底改变了恶性肿瘤的治疗理念,成为多种恶性肿瘤的主要治疗手段并给患者带来了长期生存获益,也启航了SCLC治疗的新时代。
基于Checkmate032研究结果和KEYNOTE028/158的汇总分析先后批准nivolumab、pembrolizumab用于SCLC的三线治疗。随后,免疫药物乘胜追击,在一线治疗中捷报频传,atezolizumab联合EC方案将广泛期SCLC的总生存期从10.3个月延长到12.3个月,得到了两个月的显著OS获益,成功实现了免疫治疗从后线到一线治疗的跨越。
在2019年WCLC上,CASPIAN研究再次刷新广泛期SCLC一线治疗OS的纪录,durvalumab+依托泊苷/铂类方案的OS达到13.0个月,FDA也批准了durvalumab治疗SCLC的孤儿药资格,未来非常有希望成为SCLC一线治疗的又一员干将。
中国作为SCLC的高发国家,对于免疫治疗有非常大的迫切需求,尤其是国际已经获批的atezolizumab和durvalumab在中国均未获批,所以研发具有自主知识产权的新药对于缓解中国SCLC治疗困境有重要意义。
目前我国有多个在研的自主研发PD-1/PD-L1抗体,其中替雷利珠单抗作为一种创新型PD-1抗体,其独特之处在于通过对抗体Fc段进行改造,降低ADCC/ADCP效应引起的T细胞耗竭,而且具有与nivolumab和pembrolizumab不同的PD-1结合表位和更优的结合动力学属性。
在前期开展的替雷利珠单抗联合化疗一线治疗中国肺癌的Ⅱ期研究中已经初步看到了在广泛期SCLC的疗效,去年WCLC报道的结果显示在广泛期SCLC队列中,一共入组了17例患者,初步观察到替雷利珠单抗联合EP方案一线治疗ES-SCLC有较好的抗肿瘤活性,ORR为47.1%,DCR为76.5%,CBR为52.9%,同时安全性也与其他免疫药物相似,提示其具有非常好的研发前景。在2019年ASCO更新的结果显示,SCLC队列的ORR达到了67%,DCR91%。而在刚刚召开的CSCO年会上,再次报道了该研究的更新结果,其中SCLC队列患者的ORR达到了76.5%,DCR为88.2%,中位至缓解时间为6周,中位PFS为6.9个月,中位OS达到了15.6个月。
基于早期研究观察到的较好活性,我作为主要研究者牵头全国50家中心共同开展了一项多中心,随机对照的Ⅲ期临床研究——BGB-A317-312,旨在探讨含铂类药物化疗联合或不联合替雷利珠单抗用于未经治疗的ES-SCLC患者的疗效和安全性,目前这项研究正在进行中,计划入组364例,希望在各位研究中心和研究者的共同努力下,相关结果能早日呈现,相信随着免疫治疗的快速发展、精准医疗的不断推进,SCLC治疗会有一个更美好的未来。
参考资料:
1.BrayF,FerlayJ,SoerjomataramI,SiegelRL,TorreLA,JemalA.Globalcancerstatistics2018:GLOBOCANestimatesofincidenceandmortalityworldwidefor36cancersin185countries.CACancerJClin.2018:68(66):394-424.
2.SherT,DyGK,AdjeiAA.Smallcelllungcancer.MayoClinProc.2008;83:355-367.
3.ShiY,XingP,FanY,etal.CurrentsmallcelllungcancertreatmentinChina.ThoracCancer.2015;6:233-238.
4.NetworkNCC.SmallCellLungCancer(Version1.2019).https://www.nccn.org/professionals/physician_gls/pdf/sclc.pdf.AccessedJuly3,2019.
5.DahanR,SegaE,EngelhardtJ,SelbyM,KormanAJ,RavetchJV.FcgammaRsmodulatetheanti-tumoractivityofantibodiestargetingthePD-1/PD-L1axis.CancerCell.2015;28:285-295.
6.ZhangT,SongX,XuL,etal.Thebindingofananti-PD-1antibodytoFcgammaRIhasaprofoundimpactonitsbiologicalfunctions.CancerImmunolImmunother.2018;67:1079-1090.
7.DesaiJ,MarkmanB,FriedlanderM,etal.Long-termexposure(LTE)totislelizumab,aninvestigationalanti-PD-1antibody,inafirst-in-humanphase1study.Proceedingsofthe110thAnnualMeetingoftheAmericanAssociationforCancerResearch2019;Atlanta,GA:AmericanAssociationofCancerResearch;
2019:AbstractCT084.
8.WangJ,ZhaoJ,WangZ,etal.Tislelizumab,aninvestigationalanti-PD-1antibody,combinedwithchemotherapyasfirst-linetreatmentforlungcancerinChinesepatients.JClinOncol.2019;37:(suppl):Abstracte14067.
来源:中国医学论坛报
作者:程颖
